검색결과 리스트
POLYMER에 해당되는 글 11건
- 2014.05.27 사출성형 이론
- 2013.11.11 엔지니어링 플라스틱 Polyketone 합성법
- 2013.10.01 동력학 이란?
- 2013.09.23 폴리카보네이트(PC : polycarbonate) 개요 1
- 2013.09.23 엔지니어링 플라스틱(엔프라)의 개요
- 2013.06.11 친수성 물질이란?
- 2013.06.04 DSC(Differential Scanning Calorimeter) 이론 및 원리
- 2013.06.04 시차열량분석시험(DSC) 방법
- 2013.05.29 분자량 측정방법
- 2013.05.29 수평균 분자량, 중량평균 분자량 정의
글
사출성형 이론
사출성형은 가장 대표적인 플라스틱의 가공법
• 복잡한 형상의 플라스틱 제품의 생산에 가장 널리 사용
– 플라스틱 바가지와 같은 단순한 제품
– 광통신 접속관, 자동차 내 외장제 등
• 소재의 다양성
– 범용플라스틱(PE, PP, ABS, PS, PMMA, PET)
– 엔지니어링 플라스틱(PBT, PA(Nylon 6/66), PC, POM, PSF, PES, PPS, PAI, PEI, PEEK)
– 비플라스틱 재료
• 철분말(주조식) 사출, 세라믹계 사출, 고무제품 사출, 엘라스토머 사출 등
• 저렴한 생산가
– 압축성형, 블로우 성형, 진공성형 등에 비해 생산 cycle time이 짧다.
– 다른 생산 방식보다 저렴하게 생산가로 복잡한 제품을 효율적으로 생산할 수 있다.
사출성형기의 구조와 기능
• 형체장치 : 직압식, 토글식, 조합식, 전기식
• 사출장치 : 스크류, 노즐, 호퍼, 히터, 금형 및 부대장치
• 유압장치 : 유압펌프, 배관, 유압모터
• 전기장치 : 제어반
• 사출성형 조건 설정법
– 수지업체에서 추천하는 수지온도와 금형온도를 설정한다.
– Short Shot양을 95 ∼ 98% 정도의 수지를 금형 내에 주입한다.
– 사출속도와 사출압을 조절하여 표면 외관문제를 개선한다.
– 보압전환 시점을 설정한다(5mm ∼ 10mm).
– 보압을 설정한다(일반적으로 약 사출압의 80% 정도).
– 보압시간을 설정한다(제품의 무게변화가 없는 시점에 설정).
– 냉각시간을 설정한다(취출시에 성형품의 변형 유,무를 확인).
'이론' 카테고리의 다른 글
| 엔지니어링 플라스틱 Polyketone 합성법 (0) | 2013.11.11 |
|---|---|
| 동력학 이란? (0) | 2013.10.01 |
| 폴리카보네이트(PC : polycarbonate) 개요 (1) | 2013.09.23 |
| 엔지니어링 플라스틱(엔프라)의 개요 (0) | 2013.09.23 |
| 친수성 물질이란? (0) | 2013.06.11 |
설정
트랙백
댓글
글
엔지니어링 플라스틱 Polyketone 합성법
Propagation[edit]
A mechanism for the propagation of this reaction using a palladium(II)-phenanthroline catalyst has been proposed by Brookhart:[7]
Polyketones are noted for having extremely low defects (double ethylene insertions or double carbonyl insertions, in red):
The activation barrier to give double carbonyl insertions is very high, so it does not occur.[6] Brookhart's mechanistic studies show that the concentration of the alkyl-ethylene palladium complex required to give double ethylene insertions is very low at any one point:
Additionally, the Gibbs energy of activation of the alkyl-ethylene insertion is ~ 3 kcal/mol higher than the corresponding activation barrier for the alkyl-carbon monoxide insertion. As a result, defects occur at an extremely low rate (~ 1 part per million).[7] The industrially-relevant palladium-dppp catalyst has also been investigated.[8]
Importance of bidentate ligands[edit]
Where palladium(II) pre-catalysts bearing monodentate phosphine ligands are used in methanol, a relatively high fraction of methyl propionate is produced. In comparison, where chelating diphosphine ligands are used, this side-product is absent. This observation is rationalized: the bis(phosphine) complex can undergo cis-trans isomerization to give the sterically favored trans isomer. The propionyl ligand is now trans- to the open coordination site or ethylene ligand, and is unable to undergo migratory insertion. Instead, solvolysis by methanol occurs, which gives the undesired methyl propionate side-product.[6]
'이론' 카테고리의 다른 글
| 사출성형 이론 (0) | 2014.05.27 |
|---|---|
| 동력학 이란? (0) | 2013.10.01 |
| 폴리카보네이트(PC : polycarbonate) 개요 (1) | 2013.09.23 |
| 엔지니어링 플라스틱(엔프라)의 개요 (0) | 2013.09.23 |
| 친수성 물질이란? (0) | 2013.06.11 |
설정
트랙백
댓글
글
동력학 이란?
동력학
Isaac Newton (1643 - 1727) 은 1687년 Principia Mathematica를
출간. 이책에서 그는 운동의 3법칙을 제안하였다.
Law 1 외부힘을 받지 않고 있는 물체는 정지하거나 일정한 속도로
움직인다. (관성의법칙)
– 힘이 작용하지 않으면 가속도는 없다.
Law 2: 어떠한 물체에 대해서도, FNET = F = ma (가속도의법칙)
Law 3: 힘은 쌍으로 작용한다: FA ,B = - FB ,A (작용-반작용의법칙)
(모든 작용에는 크기가 같고 방향이 반대인 반작용이 있다.)
뉴턴의 제 1법칙
• 아리스토텔레스: 물체는 정지해 있는 것이 본성
• 갈릴레오: 물체는 다른 힘이 작용하지 않는 한 운동하는
물체는 계속 운동을 하고, 정지한 물체는 계속 정지해
있다.
•관성이란?
뉴턴의제 2법칙
어떠한 물체에 대해서도, FNET = F = ma.
물체의 가속도 a는 물체에 작용하는 알짜힘FNET에
비례한다.
비례상수를 “질량”이라고 부르고, m으로 나타낸다.
» 질량의 정의 (관성질량) cf. 중력질량
» 물체의 질량은 그 물체의 일정한 성질이고, 외부 작용에
무관한다.
힘의 단위: [kg m/s2] = N (Newton)
알짜힘
• 힘이 같으면 알짜힘이 영이고 상자는 움직이지 않고(b)
• 힘이 다르면 알짜힘이 영이 아니고 상자는 움직인다. (c)
뉴턴의제 2법칙...
힘이란 무엇인가?
힘은 밀리거나 당겨지게 하는 것.
힘은 크기와 방향이 있다. (vector).
힘의 합성법은 벡터의 합성법과 같다.
'이론' 카테고리의 다른 글
| 사출성형 이론 (0) | 2014.05.27 |
|---|---|
| 엔지니어링 플라스틱 Polyketone 합성법 (0) | 2013.11.11 |
| 폴리카보네이트(PC : polycarbonate) 개요 (1) | 2013.09.23 |
| 엔지니어링 플라스틱(엔프라)의 개요 (0) | 2013.09.23 |
| 친수성 물질이란? (0) | 2013.06.11 |
설정
트랙백
댓글
글
폴리카보네이트(PC : polycarbonate) 개요
Ⅰ. PC (Polycarbonate)
1. PC의 개요
PC는 5대 범용 EP중에서 유일한 투명수지(비결정성 수지)로 가장 높은 성장률을 나타냄.
제조방법에 따라 여러가지 타입이 있으나 현재 공업용으로 생산되고 있는 것은 비스페놀A를
원료로 하는 중합법와 포스겐 / NaOH를 원료로 한 포스겐법이 주류를 이루고 있다.
최초의 생산은 1959년 독일의 Bayer에 의해 이뤄졌다.
2. PC의 특징
가. PC의 장점
▶ 내충격성 - EP 수지중 발군의 충격강도를 갖음
▶ 투명성 - 가시광선 투과율 : 80 ~ 90%
▶ 내열성 - 실 사용온도 범위 : -40℃ ~ 120℃
▶ 칫수안정성 - Creep 변형 / 칫수변화 적어 정밀성형에 최적
▶ 난연성 - 자기 소화성이 있어 전기/건재 용도에 적합
▶ 무독성 - 독성이 없어 식기, 의료기 용도에 적합
▶ 내후성 - 내 자외선성이 뛰어나 옥외 용도에 적합
나. PC의 단점
▶ 내화학 약품성 저하
▶ 내응력 Crack성 저하
▶ 내마찰 / 마모성 저하
'이론' 카테고리의 다른 글
| 엔지니어링 플라스틱 Polyketone 합성법 (0) | 2013.11.11 |
|---|---|
| 동력학 이란? (0) | 2013.10.01 |
| 엔지니어링 플라스틱(엔프라)의 개요 (0) | 2013.09.23 |
| 친수성 물질이란? (0) | 2013.06.11 |
| DSC(Differential Scanning Calorimeter) 이론 및 원리 (0) | 2013.06.04 |
설정
트랙백
댓글
글
엔지니어링 플라스틱(엔프라)의 개요
Ⅰ. 엔지니어링 플라스틱(EP)의 정의
1. 개념상의 정의 - 범용수지의 약점을 보완한, 특히 플라스틱의 최대 약점인 열적 성질과
기계적 강도를 향상시켜서 구조 재료로 사용할 수 있는 플라스틱 소재
2. 광의의 정의 - 광범위한 온도와 기계적 응력 및 까다로운 화학적, 물리적 조건에서
장시간 구조물로 사용할 수 있는 물성을 가진 플라스틱
Ⅱ. 엔지니어링 플라스틱(EP)의 특성
EP의 주요특성
- 넓은 온도 범위에서 기계적 강도가 우수함.
- 내약품성, 내후성, 장기 내열성 등이 우수하며 내환경성이 뛰어남.
- 전기적 특성이 우수하고 불연성 내지 난연성을 나타낼 수 있음.
- 가공성이 우수함.
EP는 일반적으로 장시간 사용온도가 100℃이상이며, 인장강도 500kg/㎠ 이상, 충격강도는 6kgf·cm/cm
이상의 물성을 가지며 기후변화에 잘 견디고 용도에 따라 난연성, 내마모성, 내약품성 등의
특성을 지녀야 한다.
'이론' 카테고리의 다른 글
| 동력학 이란? (0) | 2013.10.01 |
|---|---|
| 폴리카보네이트(PC : polycarbonate) 개요 (1) | 2013.09.23 |
| 친수성 물질이란? (0) | 2013.06.11 |
| DSC(Differential Scanning Calorimeter) 이론 및 원리 (0) | 2013.06.04 |
| 시차열량분석시험(DSC) 방법 (0) | 2013.06.04 |
설정
트랙백
댓글
글
친수성 물질이란?
○ 친수성 기초물질
– 이것은 수용성 고분자이다. 수용성 고분자 물질로는 여러 가지가 있
다. 카라야, 트라가칸스, 가티, 구아르 등의 천연 껌이나, 폴리비닐알
코올, 폴리비닐피롤리돈 등의 합성수지, 카르복시메틸, 하이드록시에
틸, 하이드록시프로필 셀룰로오즈, 폴리아크릴산, 폴리에틸렌이민 등
이 예이다. 전분이나 개질 전분, 또는 이들의 혼합물도 좋은 예이다.
– 전분은 비겔화 전분, 왁스형 전분, 아밀로즈 함유전분 등이 사용된다.
비겔화 전분이라 함은 수용액 상태에서 가열했다가 냉각하여도 점성
있는 반 고체형의 겔 상태로는 되지 않는 것이다. 왁스형 전분은 아
밀로즈를 10중량% 이하 함유하면서 아밀로펙틴을 함유하는 옥수수전
분이 대표적이다. 아밀로즈 함량이 10% 이하로 적으면 겔화가 잘 안
된다.
– 아밀로오스를 25중량% 이상 함유하는 겔화전분도 적절한 방법으로
겔화를 억제하거나 방지하는 방법을 통해 사용가능하다. 겔화 전분
을 가열하여 녹인 후, 급랭을 하면 겔화를 방지할 수 있고, 천천히
실온으로 냉각하여 겔화된 후에도 교반과 진동으로 겔을 풀어줄 수
도 있다.
– LMC에 사용하기에 적당한 전분은 쌀, 옥수수, 카사바, 감자 등에서
추출한 전분들이다. LMC에는 전분이 4~6%w/v 들어간다. 여기서
%w/v의 뜻은 각 구성분의 투입량(gr)을 전체 용액의 부피(ml)로 나
누어 100을 곱한 값이다.
'이론' 카테고리의 다른 글
| 폴리카보네이트(PC : polycarbonate) 개요 (1) | 2013.09.23 |
|---|---|
| 엔지니어링 플라스틱(엔프라)의 개요 (0) | 2013.09.23 |
| DSC(Differential Scanning Calorimeter) 이론 및 원리 (0) | 2013.06.04 |
| 시차열량분석시험(DSC) 방법 (0) | 2013.06.04 |
| 분자량 측정방법 (0) | 2013.05.29 |
설정
트랙백
댓글
글
DSC(Differential Scanning Calorimeter) 이론 및 원리
DSC는 sample과 reference furnace에 공급된 보상 에너지로부터 얻은 온도, 열량 변화 data로부터 시료의 물리적, 화학적 성질을 알 수 있다. 이때 피크의 위치, 모양, 개수 등으로부터 정량적인 정보들을 얻을 수 있으며 피크의 면적으로부터 열량 변화의 정량적인 정보를 얻을 수 있다. 특히 시료가 고분자 물질인 경우에는 매우 중요한 정보들을 얻기에 유용하다. 이와 같은 DSC thermogram으로부터 유리전이 온도(glass transition temperature : Tg), 냉결정화 온도(cold crystallization temperature : Tcc) , 녹는 온도(melting temperature : Tm), 결정화 온도(crystallization temperature : Tc), 등의 것들 외에도 결정화 시간, 순도, 산화, 분해 등에 관련된 정보를 얻을 수 있고 이를 통해 알고자 하는 고분자의 열적 특성을 알 수 있다.
고분자 재료나 금속 재료와 같은 물질이 녹거나 하나의 형태에서 다른 형태로 전이하는 물리적 상태의 변화가 일어날 때, 혹은 화학적으로 반응이 일어날 때에는 항상 열이 흡수되거나 방출된다. 열분석이란 일정 조건하에서 온도에 따른 시료의 무게 변화, 엔탈피나 열용량의 변화와 같은 물리적, 화학적 특성의 변화를 측정하는 분석 방법으로 이 변화를 온도 또는 시간의 함수로 기록하는 것을 말한다.
열분석법에는 측정 파라미터에 따라 DSC(differential scanning calorimeter), TGA (thermogravimetric analysis), TMA(thermomechanical analysis), DTA(Differential thermal analysis)로 나눌 수 있다.
- DSC : sample과 reference의 온도를 변화시키면서 energy 입력차를 온도의
함수로서 측정
- TGA : sample의 온도를 변화시키면서 그 sample의 질량 변화를 온도의 함수로서 측정
- TMA : sample의 온도를 변화시키면서 load를 가해 그 sample의 dimension의 변화를
온도의 함수로서 측정
- DTA : sample과 reference의 온도를 변화시키면서 그 sample과 reference간의 온도차를 온도의 함수로서 측정
여기서는 열분석 방법 중 DSC 기기에 관해 설명하려 한다.
고분자는 분자사슬중의 어느 길이(segment)를 단위로 보며 이러한 segment의 회전에 의한 열운동을 micro-Brownian motion이라 한다. 이러한 열운동이 일어나기 시작하는 온도가 유리전이 온도(glass transition temperature)로 2차 전이 온도(second order transition temperature)라고도 불리며 고분자 물질의 특징이다. 고분자는 비결정성 고분자를 제외하고는 어떤 정해진 온도에서 녹아 용융상태가 된다. 이온도를 녹는점 혹은 녹는 온도라 하는데 결정 전체가 녹아 용융상태로 되어 버리는 동안 주어진 열은 용융잠열로 물질에 흡수된다. 결정성 고분자의 경우 가장 마지막의 결정이 완전히 흩어질 때의 온도인 융점(melting point)을 갖는다.
결정성 고분자인 경우 결정이 형성되는 속도가 최고일 때의 온도를 결정화 온도(crystalline temperature)라고 한다.
고분자 물질은 결정화 온도(Tc), 녹는 온도(Tm) 및 유리전이 온도(Tg)를 나타내며 분해를 하게 된다. 따라서 온도변화에 따르는 열에너지 변화를 측정할 수 있는 DSC는 고분자 물질 연구에 많이 이용되고 있다. 특히 고분자 물질은 다른 물질에 비해 대체로 낮은 온도와 좁은 온도범위 내에서 물리적 성질의 변화가 나타난다. DSC는 온도변화에 대한 물질의 상태를 매우 빠르게, 그리고 높은 정밀도를 가지고 해석할 수 있어서 물질의 물성연구에 가장 먼저 사용된다.
'이론' 카테고리의 다른 글
| 엔지니어링 플라스틱(엔프라)의 개요 (0) | 2013.09.23 |
|---|---|
| 친수성 물질이란? (0) | 2013.06.11 |
| 시차열량분석시험(DSC) 방법 (0) | 2013.06.04 |
| 분자량 측정방법 (0) | 2013.05.29 |
| 수평균 분자량, 중량평균 분자량 정의 (0) | 2013.05.29 |
설정
트랙백
댓글
글
시차열량분석시험(DSC) 방법
▷ 시험목적
온도를 서서히 높이면 온도변화에 대한 물질의 상태변화는 각각의 물질 따라 특성이
다르기 대문에 이 과정에서의 상태변화를 조사함으로써 시료는 어떤 물질이 어느 정
도 함유되어 있는가를 알 수 있다. 특히, 탄산칼슘 및 수산화칼슘을 정량하여 탄산화
의 정도를 정량적으로 파악하고자 할 때 유용하게 적용된다.
▷ 측정원리
콘크리트 시료로부터 채취한 시멘트경화체 부분의 온도를 높이면 먼저, 자유수가 증발
하고 계속 온도를 높이면 시멘트경화체를 구성하고 있는 물질이 변화한다. 예를 들면
수산화칼슘의 탈수분해 및 탄산칼슘의 탈탄산 가스분해이다. 이처럼 시멘트경화체조직
의 변화에는 발열이나 흡열 또는 중량의 변화를 동반한다. 이 과정에서의 상태변화를
조사함으로써 시료는 어떤 물질이 어느 정도 함유되어 있는 가를 알 수 있다.
콘크리트의 경우 열분석은 보통 열중량측정(T hermogravimetry : T G)과 시차열분석
(Differential T hermal Analy sis : DTA)에 의해 행해진다.
열중량 측정 (T G)
열중량 측정장치를 사용하여 승온에 따른 시료의 중량변화를 측정하는 것으로 소량의
시료를 전용용기에 중량을 측정하여 투입한 후 시료 홀더에 올려놓은 후 가열로에 삽
입하여 각종 가스를 흘리면서 프로그램에 저장된 승온속도로 가열한다. 가열되는 시료
에 증량 또는 감량이 발생한 경우에 천평의 빔의 변화를 광전소자가 검출하여 그 신
호를 증폭시켜 피드백한다. 이것을 받아서 변화된 천평의 빔을 원래의 상태로 돌려놓
기 위해 전류가 공급되고 그의 전류값에 상당하는 중량의 변화가 기록되는 구조로 되
어 있다.
'이론' 카테고리의 다른 글
| 친수성 물질이란? (0) | 2013.06.11 |
|---|---|
| DSC(Differential Scanning Calorimeter) 이론 및 원리 (0) | 2013.06.04 |
| 분자량 측정방법 (0) | 2013.05.29 |
| 수평균 분자량, 중량평균 분자량 정의 (0) | 2013.05.29 |
| 고분자란? (0) | 2013.05.25 |
설정
트랙백
댓글
글
분자량 측정방법
1) 말단기 정량법
- 분자연쇄 말단에 있는 관능기를 정량분석하여 분자량을 구하는 방법
- 시료 중의 관능기의 양을 측정하여 수평균 분자량을 측정
- 분자량이 큰 경우 분자연쇄 내의 말단기의 비율이 상대적으로 감소 - 부정확
- 분자량 25,000 이내에서만 측정가능
- 말단기가 있는 단계중합 고분자에서 가능
- 부가중합계 고분자에서는 적용하기 어렵다.
2) 총괄성(colligative property) 이용법 :삼투압, 증기압강하, 비점상승, 응고점강하 등
- 총괄성(colligative property)
: 용질분자의 농도에만 의존하고 용질의 성질에는 무관한 성질
- 총괄성을 이용한 평균분자량 측정에서의 가정
(1) 측정된 성질의 값은 고분자 본래의 성질, 용매, 용액의 농도, 온도에 의존한다.
(2) 고분자 성질의 함수적 의존성은 모든 분자량에 대해 같다.
(3) 시료 내의 용질분자는 독립적으로, 부가적으로 용액 성질의 측정값에 기여한다.
- 순수용매의 농도에 가까운 극도로 묽은 용액에서만 가능한 성질
3) 광산란법
: 중량평균 분자량을 구하는데 사용되는 방법
(1) 빛의 산란
- 입사광이 산란체와 충돌한 후 입사광과 같은 진동수의 빛이 흩어지는 현상
- 산란광의 강도는 산란체의 다음의 성질에 의존한다.
- 용매와 용질의 분극률의 차
- 용질분자의 크기와 모양
- 용질의 농도
(2) 고분자용액의 광산란
- 고분자화 될수록 분자의 변동량 증가
- 변동량이 클수록 광산란 효과의 증가
4) 초원심법
- 고분자 용액을 원심분리하고 이때의 침강속도와 농도분포를 분석하여 분자량과 분자량분포를 측정
(1) 침강속도법
- 침강계면 : 용매상과 용질상의 분리가 일어나 형성되는 경계면
- 원심분리 시간이 경과함에 침강계면이 이동
- 침강계면의 이동속도를 측정하여 분자량 측정
(2) 침강 평형법
- 일정한 원심력장 안에서 분자의 열운동에 의한 확산과 원심력에 의한 침강이 평형을
이루는 상태
5) 점도법
- 고분자 용액의 점도는 동일 농도에서 분자량이 증가할수록 증가
- 이러한 성질을 이용하여 점도계를 통해 점도를 측정 비교하여 분자량 측정
(1) 점도의 표현법
* 상대점도(relative viscosity; ηrel)
ηrel = η/ηo
η : 고분자 용액의 점도
ηo : 용매의 점도
* 비점도(specific viscosity; ηsp)
용매에 대한 용질의 점도의 비
ηsp = (η-ηo)/ηo =ηrel -1
* 환원점도(reduced viscosity; ηred)
비점도는 용질의 농도에 비례하므로 이를 용액농도로 나누어 보정한 점
ηred = ηsp/c
* 극한점도(intrinsic viscosity; 〔η〕)
이상성을 갖는 무한 희석용액의 환원점도
〔η〕= lim ηred = lim (ηsp)/c = lim (lnηrel)/c
(2) 분자량과 〔η〕의 관계
〔η〕=KMα
K, α : 고분자의 종류, 용매, 온도에 따라 정해진 상수
0.5 < α < 1
Polymer handbook에 K, α 값이 게재되어 있으므로 이용 가능
점도법 (viscometry) - 희석 용액 점도법
희석 용액 점도법 - 고분자 용액의 점도를 모세관 점도계로 측정
경제적, 실험 용이. 가장 널리 이용됨.
원리 : 점도는 고분자의 크기(분자량)에 비례
( 점도는 용매의 종류, 온도, 농도 등에도 비례
→ 절대 평균 분자량이 아닌 상대 분자량이 측정됨.)
점도의 종류 : 상대 점도, 비점도, 환원 점도, 본성 점도, 고유 점도,
고유점도(Intrinsic viscosity. IV)가 가장 중요
고유 점도를 측정하는 방법
a) 여러 번의 측정으로부터 얻는 방법
b) 한 번 측정하여 얻는 방법.
Huggins의 식
Kramer의 식
Huggins의 식과 Kramer의 식은 k', k"의 값을 알아야 함
보통의 경우 k'는 k"보다 크며 k'-k"=0.5이다.
Solomon의 식(k'-k"=0.5라고 가정)
윗 식들을 polt에서의 직선성이 잘 알려진 고분자-용매계에 이용
고유점도가 구해지면
위의 식으로부터 점도 평균 분자량을 구할 수 있다.
6) 겔투과 크로마토 그라피(Gel Permeation Chromatography; GPC)
- 고속액체크로마토그라피(HPLC)의 분리양식의 일종
- 소량의 시료(수 ㎎)로도 간편하게 평균분자량(Mn, Mw, Mz)과 분자량분포를 측정
- 최근에 급속히 보급되는 방법
(1) 고속액체크로마토그라피(HPLC)
- 액체수송용 펌프, 시료주입구, 분리 컬럼, 검출기로 구성
- 각 성분의 컬럼 내에서의 평균이동속도 차에 의해 분리
(2) GPC에 의한 분리
- 컬럼 내에서 용질의 분자 크기에 따라 분리
- 이미 분자량을 알고 있는 표준시료를 사용하여 작성된 보정곡선으로부터 구한다.
(3) GPC로부터의 분자량 계산
자동으로 컴퓨터 처리되어 분자량 및 분자량 분포의 분석
-GPC (Gel permeation Chromatography)
원리 : 다공성 물질에 고분자가 통과할 때 작은 분자는 체류 시간이 길고 큰 분자는 체류 시간이 짧다.
큰 분자는 빨리 통과 (pore에 들어가지 못함)
작은 분자는 시간이 걸림 (pore에 오래 체류)
용매는 일종의 carrier liquid
시료와 용매가 column 통과 → 체류 시간 차이로 고분자 분리 → 감지기가 이를 감지
감지기(detecter)의 종류
굴절계(refractive index, RI)
자외선 흡광 광도계(ultraviolet, UV)
GPC chromatogram
GPC Chromatogran은 상대적인 분자량 분포 곡선임
(높이)는 분자량 ×갯수에 비례
A : 비례 상수를 구하는 방법 - 분자량을 아는 polystyrene 표준 시료를 이용하여 분자량과 체류부피의 calibration curve를 그림
ex) 표준 시료
A 3,500,000
B 500,000
C 68,000
D 9,200
E 1,700
[Fig. ] [Fig. ]
calibration curve를 이용하면 와 를 구할 수 있음.
문제점 : 보정 곡선에서의 VR에 해당하는 분자량은 polystyrene의 분자량임.
→ 측정하는 고분자의 분자량으로 바꾸어 주어야 함.
각종 고분자의 [η]M과 체류 부피와의 관계 --> [그림 3-16] universal 보정곡선 동일 에서는 표준 시료 A, B, C, D, E의 분자량을 윗 식을 이용하여 바꾸어 준 후 보정 곡선 작
(4) 저각도 레이저 광산란 검출기(LALLS)-GPC
* GPC의 한계점
① 표준시료와의 환산치이므로 실제분자량 측정의 어려움
② 분자량 분포가 실제보다 넓음
③ 흡착성이 강한 고분자에서의 정확한 측정의 어려움
▶분리막 삼투법 (Membrane Osmometry)
총괄적 성질을 이용한 수평균 분자량의 측정 방법 중 가장 널리 사용됨.
분리막 삼투압법의 원리
용매 분자가 용액 쪽으로 이동하여 압력차가 발생.
평형 상태에서의 압력 : 삼투압
. Van't Hoff의 식
정적 삼투압계 : 평형 상태 도달후 높이차 측정
장시간 소요 (수시간- 일)
동적 삼투압계 : 용매의 유속을 감지하고 유속이 0이 되도록 용액 쪽에서 가압시킴.
가한 압력이 삼투압이 됨.
단시간 소요 (5-10분)
▶증기압 삼투압법 (Vapor Phase Osmometry)
Raoult의 법칙 - 각 성분의 증기압은 mole 분율에 비례
용질의 mole 수가 많을수록 용매의 증기압 저하.
ΔP : 용질에 의한 증기압 강하량
ΔP가 매우 적으므로 측정 곤란 → ΔT로 환산(Clausius-Clapeyron식 이용)
▷총괄적 측정 방법에 의한 분자량 측정 범위
총괄적 측정법
분자량
비점 상승법
30000 이하
빙점 강하법
30000 이하
분리막 삼투압법
30000 ~ 106
증기상 삼투압법
30000 이하
▷수평균 분자량의 측정
30000 이하 - 증기상 삼투압법
30000 이상 - 분리막 삼투압법 ������������
▷중량 평균 분자량 측정법
광 산란법 (light scattering)
원리
순수한 용매 ; 광 통과시 밀도 fluctuation에 의해 산란.
용액(용매+용질) ; 광 통과시 밀도 및 농도 fluctuation에 의해 산란
--> 고분자의 분자량 측정 가능.
입자에 의한 빛의 산란
입자가 작을 때 입자가 클 때 (고분자의 경우)
↓ ↓
산란광의 상호 간섭이 없음. 산란광이 상호 간섭됨
a) 입자가 작을 때
산란된 빛의 세기가 각도에 관계없이 일정.
Debye의 식
c : 용질의 농도
Rθ : Rayleigh ratio
τ : 탁도 산란광의 세기에 비례
A : virial 계수
K, H : 산란 상수
좌변의 양을 농도에 대해 plot 하고 c=0으로 외삽하면 분자량 구해짐.
Debye의 식에서 분자량은 산란광의 세기(Rθ 또는 τ)에 관계됨.
산란광의 세기는 질량의 제곱에 비례하므로 여기에서의 분자량은 중량 평균 분자량임.
b) 입자가 클 때 - 고분자에 적용
간섭에 의해 산란된 빛의 세기는 산란각에 따라 다름.
산란각 θo → 간섭 없음.
산란각이 커지면 간섭 현상이 커짐.
산란각 θ에서의 빛의 세기
산란각 0o에서의 빛의 세기
P(θ) : 산란 인자 (scattering factor)
Oo에서는 1 θ가 증가하면 증가 P(θ)는 각도 및 입자 모양에 영향 <-- 실험에 의해 구함
주의점 - 산란을 일으킬 수 있는 다른 이물질이 없어야 함.
원심 분리범
구형 생체 고분자들의 분자량 측정에 이용.
linear polymer는 entanglement에 의해 신뢰성 저하.
원리 : 고분자를 원심분리기에 넣고 침강
침강 속도는 분자량에 비례
침강 평형 방법 - 저속(수천 r.p.m.) 장시간 초 원심 분리, 침강과 확산이 평형 을 이루었을 때 분자량 측정.
침강 속도 방법 - 고속(수만 r.p.m.), 침강 속도 측정하여 분자량 측정.
a) 침강 평형 방법
평형이 되었을 때 표면 가까운 지점과 바닥 가까운 지점의 농도 측정.
회전 중심으로부터 두 지점까지의 거리
각 지점 농도
ρ : 용액 밀도
ν : specific volume
ω : 각속도
'이론' 카테고리의 다른 글
| 친수성 물질이란? (0) | 2013.06.11 |
|---|---|
| DSC(Differential Scanning Calorimeter) 이론 및 원리 (0) | 2013.06.04 |
| 시차열량분석시험(DSC) 방법 (0) | 2013.06.04 |
| 수평균 분자량, 중량평균 분자량 정의 (0) | 2013.05.29 |
| 고분자란? (0) | 2013.05.25 |
설정
트랙백
댓글
글
수평균 분자량, 중량평균 분자량 정의
※ 수평균분자량(number-average molecular weight Mn)
- 분자의 수에 대한 평균값
- 저분자량 성분에 민감하다.
- 다른 평균분자량 값에 비해 적은 값을 나타낸다.
- 말단기정량법이나 총괄성 이용 측정법, 특히 삼투압법으로 측정
▷수평균 분자량 - 고분자의 개수를 중시
작은 분자의 개수가 제일 많고, 분자량이 커지면 개수는 감소.
고분자 시료 전체의 무게를 전체 분자 수로 나눈 값
※ 중량평균 분자량(weight-average molecular weight Mw)
- 고분자량체의 기여도가 중요하게 반영됨
- 수평균분자량보다 크다.
- 광산란법으로 측정가능
▷중량 평균 분자량 - 고분자의 무게를 중시
저 분자량 - 개수는 많지만 무게가 적다
고분자랑 - 무게는 크지만 개수가 적음.
따라서 중 분자량의 wi가 최대.
는 분자량의 제곱에 비례하므로 큰 분자에 민감.
※ Z평균 분자량(Z-average molecular weight Mz)
- 고분자량체의 기여도를 더 중요하게 반영하기 위한 수식표현방법
- 수평균분자량이나 중량평균분자량보다 크다.
- 초원심분리법으로 측정가능
▷Z 평균 분자량 - 중량 평균 분자량보다 무게 가중치가 높다.
Z 평균 분자량 측정 (유일한 방법)
단점 : 시간이 오래 소요 (수일)
(b) 침강 속도 방법
침강 속도와 용질의 질량과의 관계
s : 침강 상수
m : 질량
f : 마찰 계수
무한 희석 용액에서는
D : 확산 계수
고분자가 분자량 분포를 갖기 때문에 D와 s도 분포를 가짐
경험식 이용
경험적 상수
침강 평균 분자량 → 분자량의 상태적 비교에만 이용.
※ 수평균 분자량, 중량평균 분자량, Z평균 분자량간의 관계
- 분산도가 클수록 각 분자량간의 차이는 증가 ( Mz > Mw > Mn )
'이론' 카테고리의 다른 글
| 친수성 물질이란? (0) | 2013.06.11 |
|---|---|
| DSC(Differential Scanning Calorimeter) 이론 및 원리 (0) | 2013.06.04 |
| 시차열량분석시험(DSC) 방법 (0) | 2013.06.04 |
| 분자량 측정방법 (0) | 2013.05.29 |
| 고분자란? (0) | 2013.05.25 |



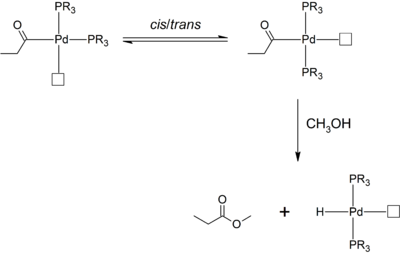


RECENT COMMENT